
产品货号:
YTB4061
中文名称:
多重PCR试剂盒
英文名称:
BalbMulti Multiplex PCR Kit
产品规格:
100T|500T
发货周期:
1~3天
产品价格:
询价
本试剂盒是一种高效、高特异性和高灵敏度的适用于对多个(可以超过20个)目标DNA片段同时进行非常均衡的PCR扩增的试剂盒。并且本产品不仅可以用于普通的多重PCR,更可以用于全血、血清或植物样品的直接PCR,便于直接用于血液样品中细菌和病毒感染、基因突变等的多重PCR检测,或者用于植物样品的基因突变、微生物感染等的多重PCR检测。
多重PCR是一种通过单个PCR反应同时对至少两个或多个DNA片段进行扩增的PCR技术。目前该技术已被广泛应用于科学研究、疾病诊断和法庭或诊断性的基因分型(Genotyping)等多个领域。该技术还可以被用于以cDNA为模板的基因定量或半定量的表达分析,其特别适合于各种动植物、真菌、细菌或病毒等微量样品进行多基因检测,具备高特异性和高灵敏度的突出优点。

- 本产品多重扩增性能优越。
本试剂盒实测可以轻松实现15个目标DNA片段的同时并且非常均衡的高效、高特异性和高灵敏度扩增(参考图1)。对于低至1pg的模板量,也可以通过仅30个PCR循环而被很好地扩增(参考图1)。普通的PCR试剂盒会由于PCR扩增时引物和模板的偏好性,对于不同的引物和不同的模板会产生不同的扩增效率,导致部分片段容易被扩增,而部分片段较难被扩增。本试剂盒使用了通过精心筛选和突变优化的非常适合用于多重PCR的DNA聚合酶BalbMulti DNA polymerase和反复优化的配套缓冲液,确保可以实现多个目标DNA片段的高效、高特异性和高灵敏度的均衡扩增。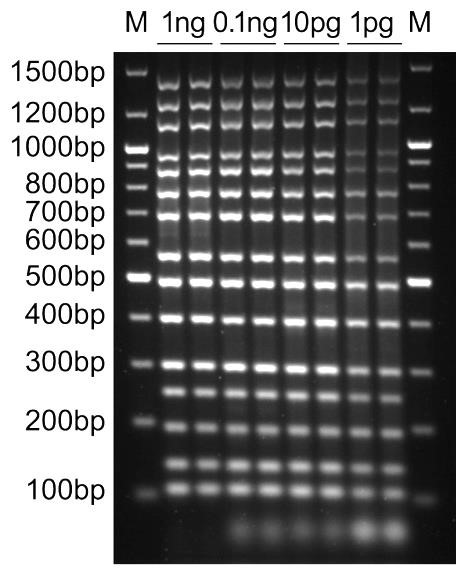
图1.百奥莱博的BalbMulti Multiplex PCR Kit进行多重PCR扩增的实测电泳效果图。以图中指定量的Lambda噬菌体基因组DNA为模板,按照本试剂盒的使用说明每个样品采用20μL PCR扩增体系,使用15对引物进行多重PCR扩增,每条引物的终浓度为0.2μM,PCR扩增条件为:94℃预变性5min;94℃变性30sec、60℃退火30sec、68℃延伸3min;最后68℃延伸10min;共30个PCR循环。PCR结束后,取2μL扩增产物进行电泳检测。扩增的片段从小到大依次为113bp、143bp、199bp、253bp、303bp、406bp、501bp、576bp、710bp、802bp、903bp、989bp、1167bp、1300bp和1463bp。M,DNA marker (0.1~10kb,21条带,货号:YT020)。图中可见低至10pg的模板就可以扩增获得15条非常单一明亮的条带,低至1pg的模板量也能扩增获得比较清晰的15条条带。同时可以观察到在模板量较低、PCR反应不完全的情况下,在100bp条带下方有过剩的引物条带存在。 - 本产品兼容血液和植物样品。
全血或血清样品无须进行DNA的提取和纯化,即可直接作为模板用于本试剂盒的多重PCR检测。本产品适用于EDTA、肝素或柠檬酸钠抗凝血样品或干血斑样品。植物样品也可以直接用于本试剂盒的多重PCR检测,完全无须对植物样品进行DNA的提取和纯化。 - 本产品提供了阳性对照,便于验证本产品的效果。
全血或血清样品无须进行DNA的提取和纯化,即可直接作为模板用于本试剂盒的多重PCR检测。本产品适用于EDTA、肝素或柠檬酸钠抗凝血样品或干血斑样品。植物样品也可以直接用于本试剂盒的多重PCR检测,完全无须对植物样品进行DNA的提取和纯化。 - 本产品的扩增产物可以用于TA克隆。
使用本产品获得的PCR产物带有3'-dA overhangs的粘性末端,可直接用于与T载体连接进行TA克隆。本产品中所使用的BalbMulti DNA polymerase的保真性和Taq DNA聚合酶相近,因此本产品主要推荐用于定性和半定量检测。

| 组分 | 100T | 500T |
| BalbMulti DNA polymerase | 100μL | 500μL |
| 10×BalbMulti PCR Buffer | 250μL | 1.2mL |
| Control template and primer mix | 25μL | 50μL |
保存:-20℃
BalbMulti DNA polymerase
- 酶来源:
大肠杆菌重组表达纯化获得。 - 质量控制:
不含DNA内切酶、外切酶和磷酸酯酶,不含RNA酶,满足常规PCR反应要求。 - 酶储存液:
20mM Tris-HCl (pH8.0),1mM DTT,0.1mM EDTA,100mM KCl,0.5% (v/v) Nonidet P40,0.5% (v/v) Tween 20 and 50% (v/v) glycerol。 - 失活抑制:
酚氯仿抽提可以使BalbMulti DNA polymerase失活。

- 引物设计对于多重PCR的成功与否至关重要。引物的设计一方面需要满足常规的引物设计规则,避免出现非特异性扩增和无法扩增,设计好的引物对应逐一通过PCR验证,然后才能选择效果较好的引物对用于多重PCR。并且引物的设计在尽可能的情况下,如果Tm值按照Tm = 2n(A) + 2n(T) + 4n(C) + 4n(C)进行计算(例如一条引物含有3个A、7个T、4个G和6个C,那么Tm = 2X3 + 2X7 + 4X4 + 4X6 = 60),Tm值不能低于60℃,通常按此计算Tm不低于65℃时用于多重PCR的效果会更佳。
- 推荐使用高质量引物(经脱盐处理、PAGE或HPLC纯化),建议使用前预先混合所用所有引物对,调整各对引物母液浓度均达到10μM,最终使其在PCR反应体系中终浓度达0.2μM。
- 推荐的延伸速度为2min/kb,对于较难扩增的靶序列,可适当调整延伸时间为3~4min/kb。
- 如果PCR产物条带较多,建议PCR反应后电泳检测的上样量调整为约2μL,过多的上样量容易导致电泳条带不太平整。
- 由于多重PCR反应非常灵敏,在使用本产品时请注意避免微量待扩增DNA的污染,建议设置不加模板的空白对照以确认是否有待扩增DNA的污染。
- 需自备dNTP和Nuclease-Free Water。推荐选购百奥莱博的dNTP Mixture (2.5mM each,货号:YTB4051)或dNTP Mixture (25mM each,货号:YTB4052),以及BalbPure Ultrapure Water (DNase/RNase-Free,Sterile,货号:YT998)。
- 对模板GC含量过高的情况,推荐使用BalbMulti PCR Enhancer (2X,货号:YTB4062)。

- 引物设计:
引物设计对于成功进行多重PCR至关重要,建议使用适当的引物设计软件进行引物设计:- 引物的长度通常为20~30个核苷酸。
- GC含量为40~60% (优选45~55%)。
- 避免所用的多个引物的3'末端出现互补序列,避免引物3'末端有3个或更多的G/C,避免引物内的二级结构。
- 在尽可能的情况下所用引物的Tm值应不低于60℃,推荐在Tm值在65~68℃之间更佳,引物间的Tm值差异应控制在5~6℃以内。此处提到Tm值按照Tm = 2n(A) + 2n(T) + 4n(C) + 4n(C)进行计算,例如一条引物含有3个A、7个T、4个G和6个C,那么Tm = 2X3 + 2X7 + 4X4 + 4X6 = 60。
- 建议扩增的目标片段不超过1500bp。虽然目标片段大约1500bp时也能被很好地扩增,但过长的片段和较短的片段同时进行PCR扩增的时候,相对更容易产生亮度不太均匀的条带。
- 建议使用经过脱盐、PAGE或HPLC纯化的引物,并溶于TE buffer (10mM Tris-Cl,1mM EDTA,pH8.0)。
- 引物的长度通常为20~30个核苷酸。
- 引物的配制:
每种合成的引物推荐配制为100μM,然后每个引物对1:1混合并加入适量水配制成10μM的引物对。例如,如果合成得到的一个5’端引物A的量是20nmol,另外一个相应的3’端引物B的量是19nmol。在引物A中加入200μL水或TE,配制成浓度为100μM,在引物B中加入190μL水或TE也配制成浓度为100μM。吸取20μL 100μM引物A和20μL 100μM引物B到一新的离心管中,再加入160μL水,混匀后即可得到可以直接用于多重PCR的引物对(10μM each)。 - 多重PCR扩增:
- 反应体系的设置。融解并混匀多重PCR反应所需的各种溶液。将BalbMulti DNA polymerase置于冰浴上或冰盒内。参考下表设置PCR反应体系。如有多个类似的PCR反应,可以先配制大体积的包含水、Buffer、dNTP和Multiplex DNA polymerase的混合物,然后分装到各PCR反应管内。同时可根据情况,将多对引物进行等浓度预混合。
成分 20μL体系 50μL体系 终浓度 样品 对照 样品 对照 Nuclease-Free Water (15-x-0.4n)μL 10μL (37.5-x-n)μL 25μL - 10×BalbMulti PCR Buffer 2μL 2μL 5μL 5μL 1X dNTP (2.5mM each) 2μL 2μL 5μL 5μL 0.25mM each Primer mix (10μM each) 0.4μL×n - 1μL×n - 0.2μM each Template xμL - xμL - - Control template and primer mix - 5μL - 12.5μL - Multiplex DNA polymerase 1μL 1μL 2.5μL 2.5μL - 总体积 20μL 20μL 50μL 50μL -
注:
① n代表多重PCR时使用的引物对种类的数量,即拟扩增片段种类的数量。
② 关于模板使用量。DNA模板的用量对PCR扩增有很大影响。对于高复杂度的DNA样本,如哺乳动物基因组DNA,推荐在20μL反应体系中使用5ng至0.5μg模板DNA。对于低复杂度的DNA,如λDNA或质粒DNA,推荐在20μL反应体系中使用5pg至5ng的模板DNA。
③ 关于PCR模板为抗凝血的情况。PCR模板为抗凝血时,模板的用量一般为PCR反应体系总体积的1~20%,建议起始使用量为5%;如果抗凝血多重PCR反应检测的是基因组的DNA片段,可以适当减少抗凝血用量;如果抗凝血多重PCR反应检测的是血液样品中某种病毒或细菌等微生物的目的DNA片段,建议使用50μL的PCR体系,并使用较大的模板血量。对于高GC含量的PCR扩增,可以使用扩增高GC含量DNA片段的BalbMulti PCR Enhancer (2X,货号:YTB4062),或者尝试向PCR体系中加入终浓度1~10% (体积百分比)的DMSO。对于干血斑样品,20μL和50μL的PCR体系中分别推荐使用约0.8平方毫米和2平方毫米的干血斑。
④ 关于PCR模板为植物样品的情况。PCR模板为抗凝血时,对于20μL和50μL PCR反应体系,植物样品的推荐用量分别为0.1~1mm和0.3~3mm直径叶片或类似大小其它比较柔嫩的植物组织。如果模板为植物种子,尽量使用鲜嫩的植物种子。用干净的解剖刀去掉种子外壳,剪下直径约0.5~2mm的组织直接放入PCR管内;若种子太小,如番茄种子,可直接使用1-2粒完整的种子放入PCR管内进行扩增。50μL PCR体系,植物叶片或是种子直径不宜超过3mm,太多模板易造成PCR抑制成分偏多,影响PCR效果。推荐取两份植物组织样品进行平行的PCR实验,以降低取样的不稳定性。为确保取样的均一性,建议使用专用的打孔器或解剖刀进行取样,并注意防止取样过程中的交叉污染。每一次取样,可以用2%的次氯酸钠溶液清洗打孔器或解剖刀。对于高GC含量的PCR扩增,可以尝试向PCR体系中加入终浓度1~10% (体积百分比)的DMSO。
⑤ 关于引物浓度。通常引物的终浓度为0.2μM时可获得良好的PCR扩增效果,但也可以根据情况在0.05~0.4μM范围内调整引物的终浓度。扩增效率低的情况下,可提高引物浓度;发生非特异性扩增时,可降低引物浓度。 - 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 如果所使用的PCR仪有热盖则省略本步骤。如果PCR仪没有热盖,则在管内滴入一滴矿物油(货号:YT399)。
- 把设置好的PCR反应体系置于PCR仪上,开始PCR反应。PCR反应的设置可以参考如下表格。
步骤 循环数 温度 时间 描述 1 - 94℃ 5min 预变性 2 30~40 94℃ 30sec 变性 60℃ 30sec 退火 68℃ 2min/kb 延伸 3 - 68℃ 10min 终延伸 4 - 4℃ Forever Hold
注1:需根据每次反应的模板、引物、PCR产物的长度和GC含量等适当优化PCR反应条件,包括退火温度、退火时间、循环数等。通常退火温度可在55~60℃范围内适当调整,或者可以对退火温度采用Touch down的方式,确保退火效果良好。
注2:对于初次进行的PCR,为尽量确保可以扩增出预期的PCR产物,可以把循环数设置为35。后续可以根据实际的PCR效果适当调整循环数。
- 反应体系的设置。融解并混匀多重PCR反应所需的各种溶液。将BalbMulti DNA polymerase置于冰浴上或冰盒内。参考下表设置PCR反应体系。如有多个类似的PCR反应,可以先配制大体积的包含水、Buffer、dNTP和Multiplex DNA polymerase的混合物,然后分装到各PCR反应管内。同时可根据情况,将多对引物进行等浓度预混合。
- 电泳检测。
多重PCR反应结束后,即可进行常规的凝胶电泳检测(对于植物等比较特殊的样品,如有必要,可以离心取上清进行电泳)。阳性对照的检测结果可以参考图1。

- PCR产物非常少或没有特异性条带。
- 引物设计不佳是PCR过程中最常见的问题。请选择适当的引物设计软件进行引物设计,注意引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在加入酶切位点等的引物中,一定要注意加入酶切位点等后整条引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在原有引物效果不佳的情况并且阳性对照引物可以正常工作的情况下,可以考虑更换引物。
- 待扩增片段GC含量偏高。向PCR体系中加入适合扩增高GC含量DNA片段的BalbMulti PCR Enhancer (2X,货号:YTB4062),并相应地根据其要求或说明调整PCR反应参数的设置。
- 部分目的片段过长。尽管BalbMulti DNA Polymerase可以扩增最长达5kb的DNA片段,但在多重PCR时,大多数时候更适合扩增1.5kb以下的片段。过长的目的片段不太适合在多重PCR时进行扩增。
- 引物的二级结构、引物二聚体或引物偏短会导致退火效果不佳。此时可以采用Touch down等方法进行退火,通常采用从65℃逐步缓慢降温到55℃或50℃的方法,使退火更加充分。
- 退火温度不佳,需要优化。如果有温度梯度PCR仪,则可以设置退火的温度梯度,摸索退火的最佳温度。如果没有温度梯度PCR仪,则可以通过多次PCR反应摸索最佳的退火温度。
- 延伸时间不足。可按照每1kb片段延伸2分钟进行设置,对于较难扩增的片段可以设置为每1kb片段延伸3~4分钟。
- 在不同PCR仪上进行PCR反应,避免有时PCR仪出现问题。
- 循环数不足,适当延长PCR的循环数。通常循环数最高不必超过40,常用的循环数范围为30-40。
- 模板用量偏少,可以适当加大模板用量。
- 对PCR引物进行脱盐甚至PAGE胶或HPLC纯化。
- 使用高质量的dNTP混合物。
- 适当增加BalbMulti DNA polymerase的用量。
- 当产生较多非特异性条带时,可以适当提高退火温度。
- 注意设置本产品提供的Control template and primer mix作为阳性对照,以确认整个多重PCR体系可以正常工作。
- 确保没有漏加任何PCR反应的组分。
- 引物设计不佳是PCR过程中最常见的问题。请选择适当的引物设计软件进行引物设计,注意引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在加入酶切位点等的引物中,一定要注意加入酶切位点等后整条引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在原有引物效果不佳的情况并且阳性对照引物可以正常工作的情况下,可以考虑更换引物。
- 杂带较多或条带弥散。
- 退火温度提高2~5℃。
- 适当检测PCR的循环数。
- 适当减少模板的用量。
- 在室温配制PCR体系容易产生非特异性条带。推荐在冰浴上配制PCR反应体系。
- 适当减少BalbMulti DNA Polymerase的用量,加入适合扩增高GC含量DNA片段的BalbMulti PCR Enhancer (2X,货号:YTB4062)。
- 适当缩短延伸时间。
- 退火温度提高2~5℃。
相关搜索:多重PCR试剂盒,全血直接PCR试剂盒,血清直接PCR试剂盒,植物样品直接PCR试剂盒,BalbMulti Multiplex PCR Kit



